생물 세포는 스스로 복제되는데 비해 바이러스는 스스로 복제되지 못하고 박테리아 같은 숙주 속에 들어간 뒤 숙주의 복제 시스템을 이용해 자신의 유전체를 복제해 증식한다.
숙주에 들어가지 못하면 단백질 덩어리인 무생물 상태로 존재하기 때문에 바이러스는 생물과 무생물의 특성을 모두 갖고 있는 셈이다.
미국 과학자들과 국제 협동연구진은 최근 살아있는 유기체와 관련된 능력을 지님으로써 살아 있는 미생물과 바이러스체 사이의 경계를 모호하게 하는 수백 종의 커다란 박테리아를 발견했다.
박테리아 속으로 침투해 이를 ‘먹이’로 삼기 때문에 박테리오파지(bacteriophages)로 불리는 이 파지(phages)들은 생명의 전형으로 간주되는 크기와 복잡성을 갖추고 있는 데다 통상 박테리아에서 발견되는 수많은 유전자를 지니고 있고, 숙주인 박테리아를 대상으로 이 유전자들을 활용하는 것으로 밝혀졌다.
이 연구는 과학저널 ‘네이처’(Nature) 12일 자에 발표됐다.
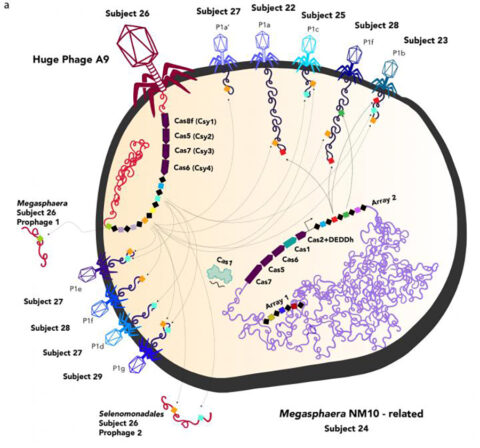
박테리아 세포를 감염시키는 거대 파지(왼쪽 빨간색)와 일반적인 파지가 박테리아에 침투하는 그림. 거대 파지가 숙주 세포에 DNA를 주입하고 있고, 일반적으로 박테리아와 고세균에서만 발견되는 CRISPR 면역시스템을 가진 이 거대 파지가 다른 바이러스에 대한 숙주 세포의 반응을 조작한다. ⓒ UC Berkeley image courtesy of Jill Banfield lab
지구 30개 환경에서 대규모 DNA 데이터베이스 생성
연구를 수행한 미국 캘리포니아대(버클리) 연구팀과 협동연구자들은 조숙아와 임신부의 장에서부터 티베트의 온천, 남아프리카의 생물반응기, 병원 입원실, 바다, 호수 및 지하 깊은 곳까지를 포함한 약 30개의 서로 다른 지구 환경으로부터 대규모 DNA 데이터베이스를 생성해 이 거대 파지들을 찾아냈다.
연구팀이 발견한 것은 모두 351개의 서로 다른 거대 파지들로, 단세포 박테리아에 침투하는 일반 바이러스들의 평균 게놈보다 네 배 이상 큰 유전체를 지녔다.
지금까지 발견된 파지 가운데 가장 큰 것은 평균적인 파지보다 거의 15배 이상 긴 73만 5000개의 염기쌍을 가지고 있었다. 이 파지의 유전체는 많은 박테리아의 유전체보다 훨씬 컸다.
논문 시니어 저자인 캘리포니아(버클리)대 질 밴필드(Jill Banfield) 교수(지구 및 행성과학, 환경과학)는 “지구의 미생물 군집을 조사하며 가끔 예기치 않은 일을 만나기도 한다”며, “이 박테리오파지들은 몸체를 복제하는 생물학 연구의 한 대상이지만 현재는 그에 관해 아는 것이 거의 없다”고 말했다.
그는 “이런 대형 파지들은 무생물과 박테리오파지 간의 간격과 함께 박테리아와 고세균류(Archaea) 사이의 간격을 메워준다”고 설명하고, “우리가 전통적으로 바이러스와 생물이라고 생각하는 것 사이에 혼종이 존재하는 것은 분명히 성공적인 생존 전략으로 보인다”고 밝혔다.
역설적이게도, 이 거대 파지들이 운반하는 DNA 안에는 박테리아가 바이러스에 대항해 싸울 때 사용하는 크리스퍼(CRISPR) 시스템 일부가 들어있었다.
일단 파지들이 자신들의 DNA를 박테리아에 주입하면 파지의 바이러스성 크리스퍼 시스템은 숙주인 박테리아의 크리스퍼 시스템을 증강시키는데, 이는 다른 바이러스들의 침입을 막는데 쓰이는 것으로 보고 있다.
논문 공동 제1저자인 UC버클리대 대학원생 알-샤에브(Al-Shayeb) 연구원은 “박테리아아나 고세균이 경쟁자들에 대항해 자신의 이익을 지키기 위해 사용했던 시스템을 이 파지들이 어떻게 용도를 바꿔 바이러스들 간의 전투에 활용하게 되었는가는 매우 흥미로운 일”이라고 말했다.

과학저널 ‘네이처’ 12일 자에 실린 논문 표지. ⓒ SPRINGER NATURE
새로운 카스(Cas) 단백질
거대 파지 중 하나는 또한 UC버클리대 제니퍼 다우드나(Jennifer Doudna) 교수와 독일 하노버대 엠마누엘레 샤르판티에(Emmanuelle Charpentier) 교수가 유전자 편집을 위해 채택한 혁명적 도구인 크리스퍼/카스9(CRISPR-Cas9)의 카스9 단백질과 유사한 단백질을 만들 수 있는 것으로 확인됐다.
연구팀은 그리스 문자 파이(Ø, phi)가 전통적으로 박테리오파지를 나타내는데 사용되었기 때문에 이 작은 단백질에 카스 파이(CasØ)라는 이름을 붙였다.
논문 공동 제1저자인 로한 사크데바(Rohan Sachdeva) 연구원은 “이 거대 파지에는 게놈 공학에 필요한 새로운 도구를 찾을 수 있는 가능성이 많다”며, “우리가 이번에 발견한 많은 유전자들은 알려지지 않은 것으로 어떤 기능을 하는지 제대로 추정할 수 없으나, 산업과 의료, 농업 분야에 활용할 수 있는 새로운 단백질 공급원이 될 수 있다”고 말했다.
이번 발견은 파지와 박테리아 간의 지속적인 전쟁에 대한 새로운 통찰을 제공하는 외에 인체 질병 관련 문제에도 영향을 미친다.
바이러스는 일반적으로 항생제에 내성을 부여하는 유전자를 포함해 세포 사이에서 여러 유전자를 운반한다. 파지들은 인체 장내 미생물군을 비롯해 박테리아와 고세균이 사는 곳이면 어디에서든 발생하기 때문에, 인체에 서식하는 박테리아에도 유해한 유전자들을 옮길 수 있다.
밴필드 교수는 “파지들이 병을 일으키거나 항생제 내성을 부여하는 유전자들 주변을 돌아다니기 때문에 일부 질병들은 간접적으로 파지에 의해 발생한다”고 지적하고, “게놈이 클수록 그런 유전자 주위를 움직일 수 있는 능력이 커지고, 인체 장내 미생물군에 바람직하지 않은 유전자를 전달할 확률이 높아질 수 있다”고 말했다.
지구의 생물군계(biomes)를 시퀀싱
밴필드 교수는 15년 이상 박테리아와 ‘박테리아의 매력적인 사촌인’ 고세균 그리고 지구의 다양한 환경에 존재하는 파지의 다양성을 탐구해 왔다.
그는 표본에 있는 모든 DNA를 시퀀싱한 다음 조각들은 모아 다시 게놈 초안을 조립하고, 경우에 따라서는 지금까지 본 적이 없는 미생물의 게놈을 완전히 새로 조립한다.
그 과정에서 그는 많은 새로운 미생물들이 아주 작은 게놈을 가지고 있어 독립적인 생명을 유지하기에는 불충분한 것으로 보인다는 사실을 발견했다. 대신 그들은 살아남기 위해 박테리아와 고세균에 의존하는 것으로 보였다.
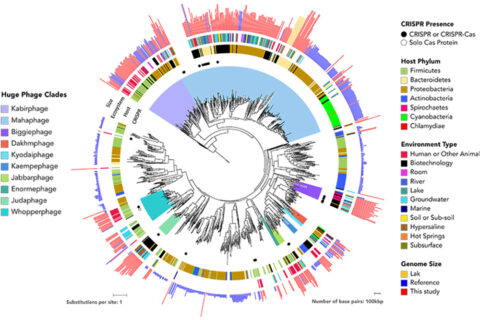
파지의 터미나아제 유전자 서열을 이용해 재구성한 거대 파지의 계통도. 내부 링과 외부 링은 CRISPR-Cas 시스템의 존재와 호스트 문(phylum), 환경 샘플링 유형과 게놈 크기를 나타낸다. 새로 확인된 10개의 거대 파지 그룹은 왼쪽에 표시했다. ⓒ Jill Banfield Lab
1년 전 밴필드 교수는 자신이 락 파지(Lak phages)라고 이름 붙인 가장 큰 파지 가운데 일부가 인체의 장과 입에서 발견될 수 있다고 보고했다. 이 파지들은 장과 침의 미생물을 먹이로 삼는다.
이번의 새로운 ‘네이처’ 논문은 밴필드 교수가 축적해 온 모든 균유전체학 서열 안에서 거대 파지들을 더욱 철저하게 검색해 나온 결과물로, 전 세계 협력연구자들이 제공한 새로운 메타게놈(metagenomes)들을 추가했다. 메타게놈이란 어떤 환경 안에서 존재하는 미생물들의 총체적인 게놈을 말한다.
이번의 메타게놈은 개코원숭이와 돼지, 알래스카 무스, 토양 표본, 바다, 강, 호수, 지하수에서 확보했고, 비소로 오염된 물을 마시고 있었던 방글라데시인들도 포함됐다.
연구팀은 길이 200 킬로베이스(kilobase) 이상인 351개의 파지 게놈을 확인했으며, 이 게놈들은 파지 평균 게놈 길이(50킬로베이스)의 네 배나 되었다. 175개 파지의 게놈은 길이를 정확하게 확인할 수 있었고, 나머지는 200킬로베이스 이상 되는 것으로 여겨졌다.
완전한 게놈 하나는 73만 5000 염기쌍으로, 지금까지 알려진 파지의 게놈 중 가장 큰 것이다.
파지 유전자, 박테리아 리보솜 방향 바꿔
이들 거대 파지에 있는 대부분의 유전자는 알려지지 않은 단백질을 코딩했다. 연구팀은 메신저 RNA를 단백질로 번역하는 리보솜 기구에서 중요한 역할을 하는 단백질의 코딩 유전자들을 식별해 낼 수 있었다. 이런 유전자들은 일반적으로 바이러스나 박테리아 또는 고세균에서만 발견된다.
연구팀은 아미노산을 리보솜에 전달해 새로운 단백질로 통합하는 많은 전이 RNA(tRNA) 유전자도 발견했다. tRNA를 운반하고 조절하는 단백질 유전자와, 번역을 활성화시키는 단백질 유전자 등이 그것이다.
사크데바 연구원은 “전형적으로 생물과 무생물을 구분하는 것은 리보솜과 단백질 번역 능력을 가지고 있느냐 하는 점으로, 바이러스와 박테리아, 생물과 무생물을 구분하는 주요 정의 특성 중 하나”라고 설명하고, “몇몇 거대 파지는 이 번역 기구를 많이 가지고 있어서 경계를 약간 흐리게 한다”고 말했다.
거대 파지들은 이 유전자들을 활용해 리보솜의 방향을 바꿔 박테리아 단백질을 희생시키면서 자신의 단백질을 더 많이 복제하는 것으로 보고 있다.
일부 거대 파지들은 또한 대체 유전자 코드인 핵산 트리플릿을 가지고 있어 RNA를 해독하는 박테리아 리보솜을 혼동시킴으로써 특정 아미노산을 부호화하는 것으로 확인됐다.
이와 함께 새로 발견된 거대 파지 중 일부는 Cas9, Cas12, CasX 및 CasY 계열과 같은 다양한 박테리아 CRISPR 시스템에서 발견된 Cas 단백질 변이체 유전자를 보유하고 있었다. CasØ는 Cas12 계열의 변이체다.
일부 거대 파지에서는 박테리아가 바이러스 침입에 대비한 참고용 바이러스 DNA 조각을 저장하는 게놈 영역인 CRISPR 배열을 가지고 있는 것으로 확인됐다. 박테리아는 이 참고용 조각으로 다시 침입한 파지를 인식한 뒤 Cas 단백질로 파지들을 겨냥해 잘라버린다.
“대형 게놈, 생존 위한 성공 전략”
밴필드 교수는 “좀 더 높은 수준에서 결론을 내리자면, 큰 게놈을 가진 파지들은 한 생태계에서만 특이적인 것이 아닌, 전 지구 생태계에서 매우 두드러진 존재”라고 강조하고, “큰 게놈을 가진 파지들은 큰 게놈을 갖게 된 긴 역사를 가진 계통이 확립돼 있으며, 대형 게놈을 보유하는 것은 생존을 위한 성공적인 전략으로서 우리는 이에 대해 잘 모르고 있다”고 지적했다.
연구팀은 이번에 발견한 351개 거대 파지들을 10개의 새로운 그룹으로 분류하고, 논문 공저자들이 사용하는 언어에서 ‘크다(big)’는 용어를 따와 각각 이름을 붙였다.
'생각해 보는 시간들' 카테고리의 다른 글
| 소풍떠난 가족 (0) | 2017.10.23 |
|---|---|
| 키네신이 단백질을 운반하는 모습 (0) | 2017.08.31 |
| 고령화와 마을소멸 (0) | 2017.08.29 |
| 외모만족도. 한국 최하위권 (0) | 2017.08.29 |
| 인간노동에 대한 로봇대체율 세계 2위 (0) | 2017.08.28 |



